Ферменти необхідні для нормального функціонування всіх живих організмів на Землі. Вони беруть участь у більшості, якщо не у всіх, хімічних перетвореннях у природі, тобто в мільйонах реакцій як у рослинному, так і в тваринному світі. Варто з’ясувати, що таке ферменти, як вони діють і яке їх значення для сучасної медицини.
Зміст
- Ферменти: Структура
- Регуляція активності ферментів
- Ферменти: Роль
- Ферменти: Номенклатура
- Ферменти та ліки
- Хвороби, що виникають внаслідок дисфункціональних ферментів
- Ферменти: використання в діагностиці
- Ферменти та лікування
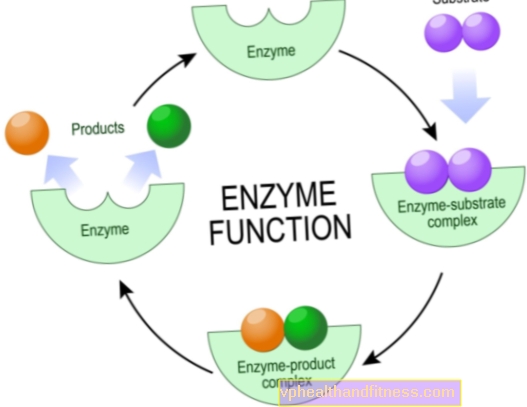
Ферменти - це білкові молекули, які прискорюють або навіть дозволяють проходити різним хімічним реакціям у живих організмах, включаючи людський організм.
З хімічної точки зору це каталізатори, тобто частинки, які підсилюють реакцію, але не зношуються під час реакції. Це збільшення ефективності хімічних перетворень часто величезне, природні каталізатори можуть скоротити час реакції з декількох років до декількох секунд.
Ферменти містяться у всіх ділянках тіла: у клітинах, у позаклітинному просторі, в тканинах, в органах та в їх світлі, те, що каталізатори виробляє дана тканина, визначає її специфічні властивості та роль, яку вона відіграє в організмі.
Більшість ферментів дуже специфічні, що означає, що кожен з них відповідає лише за один тип хімічної реакції, в якій беруть участь конкретні частинки - субстрати, і лише вони можуть взаємодіяти з даним ферментом.
Активність природних каталізаторів залежить від багатьох факторів: середовища реакції, наприклад температури, рН, присутності певних іонів, активаторів - вони підсилюють дію ферментів та інгібіторів, які протидіють цій активності.
Ферменти: Структура
Як зазначалося, більшість ферментів є білками, вони мають дуже різноманітну структуру: від декількох десятків амінокислот до кількох тисяч, розташованих у різноманітній просторовій структурі.
Саме форма їх утворення (так звана четвертинна структура) і той факт, що більшість ферментів набагато більше реагентів їх реакцій, значною мірою відповідає за їх активність.
Це пов’язано з тим, що лише певна область у структурі ферментів є так званим активним центром, тобто фрагментом, відповідальним за проведення реакції.
Завдання решти фрагментів молекули - приєднати певний субстрат, рідше інші сполуки, що впливають на активність ферменту.
Варто знати, що структура каталізатора спроектована таким чином, щоб стикувальна підкладка була ідеально підібрана з точки зору "ключа до замка".
Як і всі білки, ферменти виробляються в рибосомах із генетичного матеріалу, щільно упакованого в ядро - ДНК, створюючи таким чином так звану первинну структуру.
Потім він кілька разів згортається - змінюючи форму, іноді додаючи цукри, іони металів або залишки жиру.
Результатом усіх цих процесів є утворення активної четвертинної структури, тобто повністю біологічно активної форми.
У багатьох випадках декілька ферментних частинок поєднуються, здійснюючи ряд хімічних реакцій і, таким чином, прискорюючи процес.
Буває, що в декількох тканинах є ферменти, які каталізують одну і ту ж реакцію, але вони структурно не схожі між собою, ми називаємо їх ізоферментами.
Назви ізоферментів однакові, незважаючи на різницю в розташуванні та структурі, але ці відмінності мають практичне застосування. Завдяки цьому вдається визначити в лабораторних дослідженнях лише ті фракції ферментів, які походять від певного органу.
Механізми дії ферментів різноманітні, але з хімічної точки зору їх завданням завжди є зменшення енергії активації реакції. Це кількість енергії, яку субстрати повинні мати, щоб відбувся процес.
Цей ефект може бути досягнутий шляхом створення відповідного середовища для проведення реакції, використання іншого хімічного шляху для отримання однакових продуктів або відповідного просторового розташування субстратів.
Кожен із цих механізмів може використовуватися ферментами.
Регуляція активності ферментів
Дія ферментів залежить від параметрів навколишнього середовища: температури, рН та інших. Кожен із природних каталізаторів має власні оптимальні показники за певних умов, які можуть в основному відрізнятися залежно від його толерантності до умов навколишнього середовища.
У разі температури більшість ферментативних реакцій швидше протікають при більш високих температурах, але при певній температурі ефективність реакції різко падає, що спричинено термічним пошкодженням ферменту (денатурацією).
За своєю структурою гормони можна розділити на дві групи:
- просто - це лише білкові частинки
- складні - які вимагають приєднання небілкової групи - кофактора до їх активності
Останні відіграють ключову роль у правильній діяльності та регуляції ферментів.
У свою чергу, кофактори можна розділити на дві групи: ті, що необхідні для функціонування ферменту, сильно пов'язані з ним - це так звані протезні групи, це можуть бути метали, органічні молекули, такі як гем.
Друга група - це коферменти, вони, як правило, відповідають за перенесення субстратів або електронів, а зв'язування їх з ферментом слабке, до цієї групи належать, наприклад, фолієва кислота, кофермент А. Варто знати, що багато вітамінів відіграють роль кофакторів.
Інгібітори виконують зовсім інше завдання, це частинки, які пригнічують ферментативну активність, зв’язуючись з ферментом.
Існує кілька типів інгібіторів:
- незворотні - вони викликають постійну інактивацію молекули, і реакція може відбуватися лише після вироблення нового ферменту
- конкурентоспроможні - в цьому випадку інгібітор має структуру, подібну до субстрату, тому вони конкурують за активний сайт. Якщо приєднаний інгібітор, реакція зазнає невдачі, поки субстрат є нормальним
- неконкурентоспроможні - такі інгібітори зв'язують фермент в іншому місці, ніж прикріплюється субстрат, тому він може прикріпитися до ферменту, але реакція не відбувається
При набагато вищій концентрації субстрату, ніж інгібітор, ефект конкурентного інгібітора долається, оскільки він переростає «конкуренцію» за активний центр, у випадку неконкурентоспроможності його ефект неможливо подолати за рахунок збільшення концентрації субстрату.
На додаток до регуляції активаторної та інгібіторної систем існує безліч інших методів контролю активності ферментів.
Вони стосуються контролю клітинної продукції на рівні утворення білка, а також регулювання так званої посттрансляційної обробки, тобто змін у структурі білкової молекули, що відбуваються відразу після її синтезу в рибосомі. Ці модифікації полягають, наприклад, у вкороченні поліпептидного ланцюга.
Інші методи регуляції стосуються сегрегації та розміщення ферментів у відповідних зонах: клітинних та у конкретних органелах або у позаклітинному відділі.
Існує ще один важливий механізм регулювання - негативні відгуки - це основна система контролю в ендокринній системі. Це працює за принципом гальмування.
Це означає, що якщо фермент виробляє занадто багато певного гормону, він зв’язується з ним, пригнічуючи його активність і зменшуючи синтез, тому сам продукт реакції пригнічує його вироблення.
Ферменти: Роль
Кожна тканина людського тіла виробляє певний набір ферментів, який визначає роль цих клітин у функціонуванні організму. Що це за ферменти, визначається генетичним кодом і які регіони активні в даній клітині.
В організм людини в будь-який час відбуваються тисячі хімічних реакцій, кожна з яких потребує певного ферменту, тому важко перелічити всі ці частинки, присутні в нашому організмі.
Однак варто знати про декілька найбільш характерних:
- Травні ферменти - що виробляються тканинами травної системи, вони розщеплюють їжу до простих сполук, оскільки лише вони можуть всмоктуватися в кров. Вони є позаклітинними ферментами, тому виконують своє головне завдання поза клітинами, де вони виробляються. Деякі з цих ферментів утворюються в неактивній формі, так звані проферменти або зимогени, і активуються в шлунково-кишковому тракті. До травних ферментів належать, наприклад, амілаза, ліпаза, трипсин.
- Міозин - це фермент, що міститься в м’язах, він розщеплює молекули АТФ, які є носіями енергії, завдяки чому він змушує м’язові волокна скорочуватися.
- Пероксидази - це окислюючі ферменти та каталази, тобто відновлювальні ферменти
- Ацетилхолінестераза - це фермент, який розщеплює ацетилхолін, один із повідомників нервової системи
- Моноаміноксидаза - це фермент, який найбільш поширений у печінці і відповідає за розщеплення адреналіну, норадреналіну та деяких ліків
- Оксидаза цитохома, дуже важливий внутрішньоклітинний фермент, відповідальний за енергетичні зміни
- Лізоцим, речовина, присутня, наприклад, у сльозах або слині, яка виконує захисні функції, знищує патогени
- Алкогольдегідрогеназа, фермент у печінці, який відповідає за розщеплення етанолу
- Лужна фосфатаза, бере участь у побудові кісток остеобластами
Ферменти: Номенклатура
Назви ферментів часто досить складні, оскільки вони походять від назви реакції, яку вони проводять, і субстрату, що бере участь у цій реакції, наприклад 5-гідрокситриптофану декарбоксилази.
Як правило, суфікс "-aza" додається до загальної назви реакції, а друга частина назви ферменту утворюється від назви сполуки, що зазнає цієї реакції.
Трапляється, що назва одна, тоді вона походить від субстрату, наприклад, лактази (ферменту, що розщеплює лактозу).
Рідше назви ферментів походять від загального процесу, який відбувається за їх участю, наприклад, ДНК-гіраза, фермент, відповідальний за обертання ланцюгів ДНК.
Деякі ферменти в кінцевому підсумку мають загальні назви або імена, надані їх відкривачем, такі як пепсин (який розщеплює білки в травному тракті) або лізоцим (бактерицидний фермент, що міститься в сльозах).
Існує також невелика група рестрикційних ферментів, які відповідають за розрізання ниток ДНК, в цьому випадку назва походить від мікроорганізму, з якого фермент був виділений.
Міжнародний союз біохімії та молекулярної біології запровадив правила іменування ферментів та розділив їх на кілька класів з метою стандартизації номенклатури.
Він не замінив назви, описані раніше, це скоріше доповнення, що використовується в основному вченими.
Згідно з правилами Європейського Союзу, кожен фермент описується послідовністю символів: EC x.xx.xx.xx - де перша цифра означає клас, наступні підкласи та підкласи і, нарешті, номер ферменту. Згадані класи ферментів:
• 1 - оксидоредуктази: каталізують реакції окислення та відновлення
• 2 - трансферази: переносні функціональні групи (наприклад, фосфат)
• 3 - гідролази: відповідають гідролізу (розкладанню) зв’язків
• 4 - ліази: розривають зв'язки за допомогою іншого механізму, крім гідролізу
• 5 - ізомерази: вони відповідають за просторові зміни молекул
• 6 - лігази: з’єднують молекули ковалентними зв’язками
Ферменти та ліки
Значення ферментів для здоров'я людини величезне. Їх правильна робота забезпечує здорове життя, і завдяки розробці аналітичних приладів ми навчились діагностувати різні захворювання за допомогою визначення ферментів. Більше того, ми можемо успішно лікувати дефіцит деяких ферментів та наслідки захворювань, але, на жаль, у цій справі ще багато чого потрібно зробити.
На сьогодні лікування причин метаболічних захворювань неможливе, оскільки ми не можемо безпечно та ефективно модифікувати генетичний матеріал для відновлення пошкоджених генів і, таким чином, неправильно продукованих ферментів.
Хвороби, що виникають внаслідок дисфункціональних ферментів
Правильне функціонування нашого організму багато в чому залежить від належного функціонування ферментів. У багатьох випадках хворобливі стани впливають на кількість ферментів, спричиняючи надмірне їх вивільнення з клітин або, навпаки, дефіцит.Далі подано лише приклади захворювань, спричинених аномальними ферментативними функціями, їх набагато більше.
- Метаболічні блоки або метаболічні захворювання
Метаболічні блоки або метаболічні захворювання - це група спадкових захворювань, спричинених накопиченням речовин у клітині через відсутність ферменту, відповідального за їх метаболізм. З часом накопичується стільки субстратів, що вони стають токсичними для клітин і всього організму.
Цих хвороб налічується кілька тисяч, їх кількість відображає безліч ферментів, що знаходяться в людському організмі, оскільки метаболічні захворювання можуть впливати на більшість генів, що кодують ферменти.
Прикладами є галактоземія або гомоцистинурія, які є рідкісними захворюваннями, найчастіше проявляються відразу після народження або в перші роки життя.
- Пухлини
Ще однією групою захворювань, при яких може бути порушена ферментативна недостатність, є рак. Окрім багатьох інших функцій, ферменти також відповідають за регуляцію поділу клітин, так звані тирозинкінази. Якщо ці ферменти виходять з ладу в цій області, може відбутися неконтрольований поділ клітин і, отже, неопластичний процес.
- Емфізема
Рідше захворювання - емфізема, в цьому випадку еластаза стає надмірно активною. Це фермент, присутній у легеневій тканині, відповідальний за розщеплення білка еластину, що міститься в легенях, серед інших.
Якщо він занадто активний, порушується баланс між руйнуванням і будівництвом, виникають рубці і розвивається емфізема.
Ферменти: використання в діагностиці
Сучасна медична діагностика базується на використанні ферментів для їх визначення. Це пов’язано з тим, що хворобливі стани прямо чи опосередковано призводять до дисбалансу ферментів, викликаючи збільшення або зменшення їх кількості в крові.
Це може бути наслідком не тільки виробничих порушень, але і, наприклад, виділення великої кількості внутрішньоклітинного ферменту в кров або сечу в результаті пошкодження її клітинної мембрани.
Прикладами ферментів, що використовуються в лабораторних дослідженнях, є:
- Креатинкіназа - фермент, присутній у м’язах, також у серцевому м’язі, його багаторазове збільшення може свідчити про інфаркт, міокардит, м’язові захворювання - травми, дистрофію.
- Лактатдегідрогеназа - присутня у всіх клітинах тіла, особливо в головному мозку, легенях, білих кров’яних клітинах та м’язах. Його велике збільшення спостерігається при інфаркті міокарда, захворюваннях м’язів та печінки або раку.
- Лужна фосфатаза в основному міститься в печінці та кістках, тут вона виділяється остеобластами. Захворювання цих органів можуть спричинити його ріст, але надлишок лужної фосфатази може також свідчити про процес регенерації кістки - після операції або перелому.
- Кисла фосфатаза зустрічається в багатьох органах - печінці, нирках, кістках, простаті, з діагностичної точки зору її збільшення може свідчити про захворювання кісток і передміхурової залози.
- Аспартатамінотрансфераза та аланінамінотрансфераза - це ферменти, характерні для печінки, що зустрічаються майже виключно в гепатоцитах, їх використовують у базовій скринінговій діагностиці захворювань печінки, і їх багатократне збільшення значень завжди спонукає до подальшої діагностики захворювань печінки.
- Глутаматдегідрогеназа та гаммаглутамілтрансфераза - інші ферменти печінки, аналогічно раніше згаданим, важливі для діагностики захворювань цього органу та жовчовивідних шляхів.
- Амілаза - фермент, присутній у багатьох органах, але найбільша концентрація досягається в клітинах підшлункової залози та слинних залоз, її діагностика має найбільше значення при їх захворюваннях.
- Ліпаза - ще один фермент підшлункової залози, він відрізняється специфічністю від амілази, а це означає, що ліпаза присутня лише в підшлунковій залозі, а відхилення від норми при визначенні цього ферменту свідчать про захворювання підшлункової залози.
- Холінестераза - це фермент, який розщеплює ацетилхолін - передавач у нервовій системі, де він також присутній у найбільшій кількості, в діагностиці застосовується при отруєнні фосфорорганічними сполуками.
- Фактори коагуляції та фібринолізу - це речовини, що виробляються печінкою, що беруть участь у згортанні крові, їх визначення важливі не тільки для оцінки цього процесу, але й для контролю функції печінки.
- Альфа-фетопротеїн - печінковий фермент, кількість якого збільшується при захворюваннях цього органу, включаючи рак.
- С-реактивний білок - виробляється печінкою, бере участь в імунній відповіді, його кількість збільшується в крові при запальних станах - інфекціях, травмах, аутоімунних захворюваннях.
- Церулоплазмін - ще один фермент печінки, збільшення якого характерно для хвороби Вільсона.
- Піридинолін та дезоксипіридинолін є маркерами резорбції (руйнування) кістки та характеризують функцію остеокластів (остеогенних клітин).
- Міоглобін - як уже згадувалося раніше, це сполука, характерна для м’язів, тому його збільшення буде свідчити про пошкодження скелетних або серцевих м’язів.
- Тропоніни - так звані маркери інфаркту, є ферментами, що регулюють скорочення м’язових волокон, їх особливо багато в серцевому м’язі. Його пошкодження спричиняє викид великої кількості тропонінів у кров, що використовується для діагностики серцевих захворювань. Однак варто пам’ятати, що збільшення тропонінів може свідчити не тільки про інфаркт, але і про його недостатність, про дефекти клапанів або легеневу емболію.
Всі перелічені вище ферменти можна класифікувати на кілька груп:
- Секреторні ферменти - нижня межа норми є діагностичною. Це ферменти, які фізіологічно виробляються органами, але у разі захворювань їх кількість зменшується, наприклад фактори згортання крові
- Ферменти-індикатори - ріст важливий. Ця група ферментів з’являється у великих кількостях через пошкодження органів та витік ферментів, до них належать, наприклад, тропоніни
- екскреторні ферменти - це ферменти, які нормально виробляються в просвіт різних органів - рота, кишечника або сечовивідних шляхів. Якщо їх вихід закритий, вони потрапляють у кров, наприклад, амілазу
Варто пам’ятати, що ферменти використовуються в самій медичній діагностиці. Біохімічні аналізи проводяться із застосуванням ферментів, а відповідна інтерпретація результатів ферментативних реакцій дозволяє отримати результат лабораторного дослідження.
Ферменти та лікування
Багато ліків діють, впливаючи на дію ферментів, або змушуючи їх діяти, або, навпаки, будучи інгібіторами. Існують замінники ферментів, такі як панкреатин, що містить ліпазу та амілазу при недостатності підшлункової залози.
З іншого боку, деякі групи препаратів пригнічують дію ферментів, наприклад, інгібітори ангіотензинперетворюючого ферменту, що застосовуються, зокрема, при гіпертонії та серцевій недостатності, або деякі антибіотики, наприклад, амоксицилін, який інгібує фермент бактеріальну транспептидазу, що перешкоджає побудові клітинної стінки бактерій, а отже, інгібує інфекція.
Деякі отрути також діють, впливаючи на ферменти. Ціанід є потужним інгібітором цитохромоксидази, важливого компонента дихального ланцюга. Блокуючи це, не можна клітині отримувати енергію, що призводить до її загибелі.
Для належного перебігу життєвих процесів клітин необхідно наявність багатьох хімічних речовин, що залишаються в строгих пропорціях між собою, і між якими постійно відбуваються хімічні реакції.
Це завдання виконують належним чином функціонуючі ферменти, які необхідні, щоб майже будь-яка хімічна реакція проходила зі швидкістю та ефективністю, необхідними для нормального функціонування людського організму.
Дія ферментів прискорює ці процеси в рази, часто навіть у сотні разів, що важливо, самі ферменти не зношуються під час протікаючих реакцій.
Відсутність каталізаторів або їх неналежне функціонування може призвести до появи багатьох захворювань. З іншого боку, вміле видозмінення їх діяльності дозволяє успішно лікувати багато недуг.
Ензимологія (наука про ферменти) надзвичайно обширна, і її розвиток може принести не тільки науковий прогрес, але і активно сприяти розвитку медицини в галузі не тільки лікування, але і діагностики.
Про автора

-i-stomatologia.jpg)