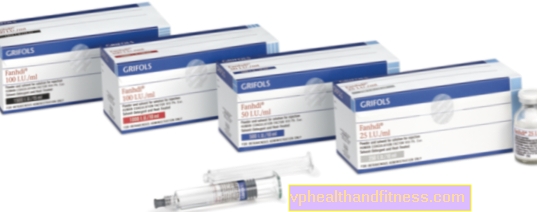
1 флакон містить 250 МО, 500 МО або 1000 МО фактор згортання крові людини VIII (FVIII) та 300 МО, 600 МО відповідно або 1200 МО людський фактор фон Віллебранда. Питома активність становить щонайменше 2,5 МО. до 10 МО FVIII: З / мг білка залежно від розміру упаковки (250 МО, 500 МО і 1000 МО). Виробляється з плазми людських донорів.
| Ім'я | Зміст упаковки | Діюча речовина | Ціна 100% | Востаннє змінено |
| ФАНДХІ | 1 флакон + 1 ампер шприц, порошок та розчин для приготування рішення для шоку та / або інф. | Фактор VIII, Фактор фон Віллебранд | 2019-04-05 |
Дія
Поєднання факторів згортання крові - фактор VIII та фактор фон Віллебранда є фізіологічними компонентами плазми людини, які діють як ендогенні компоненти. Введення фактора фон Віллебранда дозволяє коректувати гемостатичні розлади, що виникають у пацієнтів з дефіцитом фактора фон Віллебранда, на двох рівнях: фактор фон Віллебранда рестабілізує адгезію тромбоцитів до ендотелію судин у місці пошкодження судин (прикріплюється як до ендотелію, так і до мембрани тромбоцитів), що призводить до первинного гемостаз, який проявляється скороченням часу кровотечі (ефект з’являється негайно і значною мірою залежить від рівня полімеризації білка); фактор фон Віллебранда викликає уповільнене збільшення супутнього дефіциту фактора VIII, внутрішньовенний фактор фон Віллебранда зв'язується з ендогенним фактором VIII (який синтезується у пацієнта), стабілізуючи цей фактор, запобігаючи його швидкій деградації. З цієї причини, введення чистого фактора фон Віллебранда (препарат із низьким фактором VIII за допомогою фактора Віллебранда) відновлює рівень фактора VIII в якості вторинного ефекту після першої інфузії. При внутрішньовенному введенні пацієнтам з гемофілією фактор VIII зв’язується з фактором фон Віллебранда в крові. Активний фактор VIII (VIlla) діє як кофактор активного фактора IX (IXa) для прискорення перетворення фактора X в активний фактор X (Xa). Активний фактор X перетворює протромбін у тромбін. Потім тромбін перетворює фібриноген у фібрин, що дозволяє утворюватися згустку. У пацієнтів з гемофілією А після ін’єкції приблизно 2/3 - 3/4 фактора VIII залишається в кровообігу. Рівень активності фактора VIII, досягнутий у плазмі крові, повинен становити від 80% до 120% від прогнозованої активності фактора VIII. Активність фактора VIII у плазмі зменшується при експоненціальному двофазному розподілі. У початковій фазі розподіл між внутрішньосудинними та іншими відділами (рідинами тіла) відбувається з періодом напіввиведення з плазми від 3 до 6 годин. У наступну, більш повільну фазу, яка, ймовірно, відображає споживання фактора VIII, період напіввиведення становить 8-18 годин, у середньому 15 годин. h.
Дозування
Внутрішньовенно. Лікування має розпочинати і контролювати лікар, який має досвід лікування порушень кровотечі. Дефіцит фактора VIII: Доза та тривалість лікування залежать від тяжкості дефіциту фактора VIIII, місця та ступеня кровотечі та клінічного стану пацієнта. 1 МО Активність фактора VIII еквівалентна кількості фактора VIII в 1 мл нормальної плазми крові людини. Введення 1 МО фактор VIII / кг збільшує активність фактора VIII у плазмі крові приблизно на 1,7% - 2,5% від нормальної активності, отже, необхідна доза розраховується наступним чином: необхідна кількість одиниць = маса тіла (кг) x бажане збільшення фактора VIII (%) x 0,5 . Кількість, яку слід вводити, і частота введення повинні завжди залежати від клінічної ефективності в даному випадку (іноді, наприклад, за наявності титру з низьким рівнем інгібітора, може знадобитися використовувати дозу, більшу, ніж розрахована за формулою). При кровотечах та хірургічних втручаннях активність фактора VIII з часом не повинна опускатися нижче таких рівнів активності (у% від норми або МО / дл): рання кровотеча в суглоби, м’язи або рот - необхідний рівень фактора VIII становить 20-40% від норми і препарат вводять кожні 12-24 години протягом щонайменше 1 доби, поки кровотеча не закінчиться (полегшення болю) або не заживе рана; більш серйозні кровотечі в суглоби, м'язи або гематоми - необхідний рівень фактора VIII становить 30-60% від норми, а вливання лікарських засобів повторюють кожні 12-24 години протягом 3-4 днів або довше, поки не зникне знеболення та гострі порушення функції; кровотечі, що загрожують життю - необхідний рівень фактора VIII становить 60-100% від норми, вливання ліків повторюють кожні 8-24 години, доки загроза не вирішиться; незначна операція (включаючи видалення зуба) - необхідний рівень фактора VIII становить 30-60%, препарат дають кожні 24 години не менше 1 доби, поки рана не заживе; велика хірургічна операція - необхідний рівень фактора VIII становить 80-100% (до та після операції), інфузії повторюють кожні 8-24 години, поки рана не заживе, потім продовжують щонайменше 7 днів поспіль, підтримуючи рівні фактора VIII на рівні 30-60 % (МО / дл). Реакція на лікування різниться в індивідуальному порядку, тому моніторинг рівня фактора VIII є надзвичайно важливим, особливо при великих хірургічних операціях. Для тривалої профілактики кровотеч при важкій гемофілії А звичайна доза фактора VIII становить 20-40 МО / кг. кожні 2-3 дні у молодих пацієнтів можуть знадобитися коротші інтервали доз або вищі дози. Хвороба фон Віллебранда. Зазвичай вважається, що введення 1 МО VWF: RCo / кг маси тіла збільшує рівень VWF: RCo в циркуляції на 2%. Метою лікування є отримання рівня VWF: RCo> 0,6 МО / мл (60%) та FVIII: C> 0,4 МО / мл (40%) у плазмі. У більшості випадків для гемостазу рекомендується доза 40-80 МО / кг маси тіла фактора фон Віллебранда та 20-40 МО / кг маси тіла FVIII: C. Пацієнтам із хворобою фон Віллебранда 3 типу, яким можуть знадобитися більш високі дози для підтримки адекватних рівнів фактора, може знадобитися початкова доза фактора фон Віллебранда 80 МО / кг маси тіла. Обрану дозу слід вводити кожні 12-24 год. Дозування та тривалість лікування залежать від клінічного стану пацієнта, локалізації та ступеня кровотечі, а також рівня VWF: RCo та FVIII: C. Протягом періоду використання препаратів фактора VIII, що містять фактор фон Віллебранда, лікуючий лікар повинен враховувати можливість надмірного підвищення рівня FVIII: C. Щоб уникнути надмірного підвищення рівня FVIII: слід розглянути можливість зниження дози та / або продовження інтервалу дозування або використання лікарських засобів, що містять VWF та меншу кількість фактора VIII, через 24-48 годин лікування. Для вищевказаного показання доступні лише обмежені дані клінічних випробувань у дітей віком до 6 років - не застосовувати. У дітей за вищезазначеними показаннями титрування до клінічної ефективності також проводиться шляхом обчислення дози відповідно до маси тіла. Препарат вводять у вигляді повільної внутрішньовенної ін’єкції (швидкість введення не повинна перевищувати 10 мл / хв).
Показання
Профілактика та контроль кровотеч у пацієнтів з гемофілією А (вроджений дефіцит фактора згортання крові у людини). Профілактика та контроль кровотечі (включаючи хірургічну кровотечу) у пацієнтів із хворобою фон Віллебранда (VWD), коли терапія десмопресином (DDAVP) неефективна або протипоказана. Препарат можна використовувати для лікування набутого дефіциту фактора згортання крові у людини.
Протипоказання
Підвищена чутливість до діючої речовини або будь-якої з допоміжних речовин.
Запобіжні заходи
Можливі реакції гіперчутливості алергічного типу. Пацієнтів слід інформувати про ранні ознаки реакцій гіперчутливості, включаючи висип, велику кропив'янку, стискання в грудях, хрипи, гіпотонію, аж до анафілактичного шоку. У разі виникнення таких симптомів прийом препарату слід негайно припинити та, відповідно, розпочати відповідне лікування. За пацієнтами, які отримують людський фактор згортання крові, необхідно ретельно контролювати розвиток інгібіторів антифактора VIII шляхом клінічного спостереження та оцінки лабораторних досліджень. Ризик розвитку інгібіторів корелює з тривалістю впливу фактора VIII, причому ризик є найвищим протягом перших 20 днів впливу. У рідкісних випадках інгібітори можуть також розвиватися після перших 100 днів впливу. Після переходу із препарату фактора VIII на інший повідомлялося про повторне утворення інгібіторів (з низьким титром) у пацієнтів, які раніше отримували лікування щонайменше 100 днів з історією утворення інгібіторів. Тому рекомендується ретельний моніторинг стану пацієнтів щодо наявності інгібіторів після будь-якого переходу на лікарський засіб. Існує ризик тромботичних ускладнень при застосуванні лікарських засобів із фактором фон Віллебранда, особливо у пацієнтів з відомими клінічними або лабораторними факторами ризику. З цієї причини моніторинг пацієнтів групи ризику необхідний для виявлення ранніх ознак тромбозу. Крім того, слід дотримуватися рекомендацій чинних рекомендацій щодо лікування та профілактики венозної тромбоемболії. Під час лікування лікарськими засобами з фактором VIII та фактором фон Віллебранда лікар повинен враховувати, що тривале лікування може спричинити надмірне підвищення рівня FVIII: C. У пацієнтів, які отримують лікарські засоби, що містять фактор VIII та фактор фон Віллебранда, слід контролювати рівні FVIII: C, щоб уникнути постійного перевищення рівня, який може збільшити ризик тромботичних ускладнень. У пацієнтів із хворобою фон Віллебранда, особливо типу 3, можуть розвинутися нейтралізуючі антитіла (інгібітори) до фактора фон Віллебранда. Якщо очікувані рівні активності VWF: RCo у плазмі крові не досягнуті або кровотеча контролюється за допомогою відповідних доз, слід провести обстеження на наявність інгібітора фактора фон Віллебранда. У пацієнтів з високим рівнем інгібітора терапія фактором фон Віллбранда може бути неефективною, і слід розглянути інші варіанти терапії. Якщо потрібна центральна венозна лінія, можуть виникнути місцеві інфекції, бактеріємія та тромбоз катетера. Слід розглянути відповідну вакцинацію (проти вірусів гепатиту А та В) у пацієнтів, які регулярно отримують похідний із плазми фактор згортання крові VIII.
Небажана активність
Гіперчутливість або алергічні реакції (набряк Квінке, печіння і пекучі відчуття в місці ін'єкції, озноб, нападоподібні припливи, генералізована кропив'янка, головний біль, висип, падіння артеріального тиску, сонливість, нудота, неспокій, тахікардія, стискання в грудях, відчуття поколювання, блювота, хрипи), що в деяких випадках призводить до важкої анафілаксії з шоком. Підвищення температури спостерігається рідко. У пацієнтів з гемофілією А можуть розвинутися нейтралізуючі антитіла (інгібітори) до фактора VIII. Коли такі інгібітори розвиваються, спостерігається недостатня клінічна відповідь на лікування. У дуже рідкісних випадках у пацієнтів із хворобою фон Віллебранда, особливо із захворюванням 3 типу, можуть розвиватися нейтралізуючі антитіла (інгібітори) до фактора фон Віллебранда. Якщо такі інгібітори трапляються, спостерігається недостатня клінічна відповідь на лікування. Ці антитіла можуть бути тісно пов’язані з анафілактичною реакцією. З цієї причини пацієнтам, у яких спостерігаються анафілактичні реакції, слід пройти тест на наявність інгібіторів. У таких випадках рекомендується звернутися до спеціалізованого центру для лікування гемостатичних розладів. Існує ризик тромботичних ускладнень, коли лікарський засіб застосовується у пацієнтів із хворобою фон Віллебранда з відомими клінічними або лабораторними факторами ризику.
Вагітність і лактація
Препарат слід застосовувати під час вагітності та годування груддю лише у разі крайньої необхідності (немає досвіду застосування препарату через рідкісне виникнення гемофілії А у жінок).
Взаємодія
Невідомі взаємодії синдрому FVIII / VWF з іншими препаратами.
Препарат містить речовину: фактор VIII, фактор фон Віллебранда
Відшкодований препарат: НІ